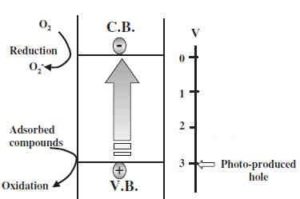
Le pitture formulate con biossido di titanio nanometrico conferiscono alle pitture stesse la proprietà fotocatalitica. La pittura però per rispondere a tale caratterista deve essere formulata e bilanciata con leganti ed altre materie prime di alta qualità ed in proporzioni specifiche che permettono il giusto funzionamento per rispondere alle reali caratteristiche fotocatalitiche.
La CASPANI S.r.l. ha lanciato un nuovo progetto CASPANI GREEN PROJECT.
La finitura fotocatalitica FOTOSAN purifica l’aria all’interno della stanza, è in grado di abbattere e trasformare le sostanze inquinanti tossiche in sostanze innocue.
La fotocatalisi è il fenomeno naturale in cui una sostanza, detta fotocatalizzatore, attraverso l’azione della luce (solare o artificiale) e dell’aria, attiva l’ossidazione e la decomposizione delle sostanze inquinanti in sostanze innocui.
Le sostanze inquinanti e tossiche che vengono trasformate sono: polveri sottili PM10, monossido di carbonio, monossido e biossido di azoto, benzene, anidride solforosa, formaldeide, acetaldeide, metanolo, etanolo, benzene, etilbenzene, mexilene.
Le sostanze inquinanti e tossiche vengono trasformate in nitrati di sodio (NaNO3), carbonati di sodio (Ca(NO3))2 e calcare (CaCO3).
La CASPANI S.r.l. applica FOTOSAN , soluzione trasparente
con il Sistema Ecoattivo FSN ( Fotocatalitico Sanificante Nebulizzato).
Il Sistema consiste nel nebulizzare la soluzione Fotosan con una speciale pompa a turbina a bassa pressione, una volta applicata Fotosan verrà attivata dalla luce solare o artificiale migliorando la qualità dell’aria e sanificando l’ambiente.
Proprietà Finitura Fotocatalitica FOTOSAN
– purificazione dell’aria dagli inquinanti presenti nell’ambiante
– proprietà autopulente e ridotta manutenzione delle superfici trattate
– forte azione antimicrobiotica e antimuffa
– azione deodorante e sanificante
La fotocatalisi eterogenea come AOP
La fotocatalisi eterogenea ha trovato nel corso degli anni numerosissime applicazioni. Recentemente, data la necessità sempre maggiore di rimuovere inquinanti da mezzi gassosi o liquidi, si è pensato di applicare la fotocatalisi ai processi di depurazione e di trattamento di sistemi inquinati. Ecco quindi come la fotocatalisi entra a far parte della categoria dei processi di ossidazione avanzata (Advanced Oxidation Processes). Questi processi si basano sulla produzione di radicali ossidrilici (HO·), specie chimiche altamente ossidanti (hanno potere ossidante molto elevato), caratterizzate da elevata reattività e forte instabilità, e per questo di vita molto breve. I radicali ossidrile sono in grado di reagire con diversi composti organici e portarli a completa mineralizzazione, con conseguente formazione di anidride carbonica e acqua. In sintesi quindi, sostanze inquinanti vengono trasformate in sostanze non pericolose né per l’ambiente né per l’uomo. L’enorme vantaggio che i processi di ossidazione avanzata offrono, è la distruzione dell’inquinante, al contrario di quanto avviene in altre tecniche più convenzionali (quali adsorbimento o condensazione), in cui la sostanza contaminante viene solamente trasferita da una fase ad un’altra (in questo modo il problema, ovvero la presenza dell’inquinante, non viene eliminato alla radice, ma viene piuttosto spostato su qualcos’altro).
Sulla base di questi presupposti, risulta chiaro come la fotocatalisi possa essere applicata alla degradazione dei composti organici volatili. La degradazione fotocatalitica di VOC è stata ampiamente studiata; nell’articolo di Wang et al. (2007) viene presentata una panoramica dei numerosi lavori che sono stati fatti al riguardo. Sono stati condotti studi relativi alla degradazione di diverse sostanze (benzene, formaldeide, acetone, acetaldeide, xileni, etc.) e in diverse condizioni di umidità, concentrazione iniziale di inquinante, presenza di altri composti nella corrente inquinata, etc. Nella gran parte dei casi, la fotocatalisi viene condotta in presenza di radiazioni UV, dal momento che i catalizzatori assorbono in questo intervallo di lunghezze d’onda. Lavori più recenti tuttavia, sono riusciti a operare con la luce solare e quindi nel range del visibile. Questo è possibile andando a modificare i catalizzatori con ioni metallici o ossidi metallici, allo scopo di spostare la loro banda di assorbimento nel campo del visibile (catalizzatori dopati). Riuscire a fare questo significherebbe semplificare notevolmente il processo di fotocatalisi e renderlo maggiormente appetibile per applicazioni reali. Lo studio di Anpo e Takeuchi (2003) riassume quanto fatto in questo senso.
Principi base della fotocatalisi eterogenea
In questo paragrafo vengono descritte le basi su cui si fonda la fotocatalisi eterogenea. La fotocatalisi eterogenea, così detta perché la fase del catalizzatore è diversa da quella dei reagenti e del mezzo di reazione, si fonda su alcuni principi fondamentali. In Figura 2.1 è riportato schematicamente il processo di fotocatalisi eterogenea, così come avviene su di una particella di semiconduttore esposta a radiazione luminosa.
La fotocatalisi per la rimozione dei VOC 35
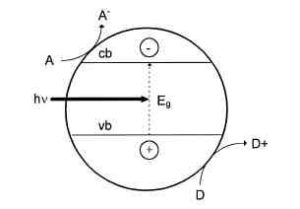 Figura 2.1 Rappresentazione schematica della fotocatalisi eterogenea su di una particella di semiconduttore esposta alla luce. A è la specie accettore adsorbita; D è la specie donatore adsorbita; vb e cb sono rispettivamente le bande di valenza e di conduzione, hν indica l’energia proveniente dalla radiazione luminosa e Eg l’energia che permette agli elettroni di essere promossi alla banda di conduzione.
Figura 2.1 Rappresentazione schematica della fotocatalisi eterogenea su di una particella di semiconduttore esposta alla luce. A è la specie accettore adsorbita; D è la specie donatore adsorbita; vb e cb sono rispettivamente le bande di valenza e di conduzione, hν indica l’energia proveniente dalla radiazione luminosa e Eg l’energia che permette agli elettroni di essere promossi alla banda di conduzione.
Innanzitutto il catalizzatore è costituito da un semiconduttore (SC); un semiconduttore è caratterizzato da una struttura elettronica a bande di energia, in cui la banda più alta occupata, detta banda di valenza, e la banda più bassa non occupata, detta banda di conduzione, sono separate da una banda cosiddetta proibita (band gap), ovvero una regione di energie proibite (non accessibili agli elettroni). In presenza di una fonte luminosa, vengono emessi fotoni. Quando un fotone di energia uguale o maggiore del band gap viene assorbito da una particella di semiconduttore, un elettrone della banda di valenza (vb) riceve l’energia sufficiente per essere promosso alla banda di conduzione + (cb). Al contempo, si crea una lacuna h nella banda di valenza. A questo punto, si possono presentare due possibili casi: o l’elettrone promosso alla banda di conduzione (e− ) e la lacuna rimasta nella banda di valenza (h+ ) si ricombinano velocemente sulla cb vb superficie o nel bulk della particella dissipando calore e ripristinando la situazione di partenza, oppure possono rimanere bloccate nei nuovi stati e lì possono reagire con le specie (donatori e accettori) adsorbite o vicine alla superficie della particella. Nel secondo caso, si hanno reazioni di ossidoriduzione anodiche e catodiche. Il livello di energia più basso della banda di conduzione è il potenziale di riduzione dei fotoelettroni; l’energia più alta della banda di valenza corrisponde invece alla capacità di ossidare delle foto lacune. Questi rispecchiano quindi la capacità del sistema di promuovere reazioni di riduzione e reazioni di ossidazione. Definito il potenziale di banda piatta (Vfb) come l’energia di entrambi i portatori di carica (elettroni e lacune), le molecole adsorbite possono essere ridotte dagli elettroni della banda di conduzione se caratterizzate da potenziale di ossidoriduzione più positivo del valore di potenziale di banda piatta della banda di conduzione; allo stesso modo, le specie adsorbite possono essere ossidate dalle lacune della banda di valenza se caratterizzate da potenziale di ossidoriduzione più negativo del potenziale di banda piatta della banda di valenza (Litter, 1999). Il primo step della fotocatalisi eterogenea è l’adsorbimento delle specie reagenti sulla superfici del catalizzatore semiconduttore: una volta che le specie reagenti sono state adsorbite la reazione può compiersi.
Ossidazione fotocatalitica (PCO)
Si è detto come una delle maggiori applicazioni della fotocatalisi sia l’ossidazione fotocatalitica (Photo Catalytic Oxidation, PCO) di contaminanti. In Figura 2.2 si riporta una schematizzazione di quanto avviene in questo processo. Il primo step consiste nella formazione di coppie elettroni – lacune nel semiconduttore (catalizzatore), la qual cosa richiede che venga fornita un’energia maggiore del band gap (banda proibita) tra banda di valenza (VB) e banda di conduzione (CB). Quando l’energia somministrata (ovvero i fotoni) supera il band gap, all’interno del semiconduttore si creano le coppie elettroni – lacune, allora ci sarà scambio di carica tra queste coppie e le specie reagenti (adsorbite sulla superficie) e avverrà la reazione di foto ossidazione. Un foto catalizzatore, per essere considerato buono, deve essere capace di adsorbire contemporaneamente due reagenti, che posano essere ridotti e ossidati, previa attivazione fotonica, attraverso un efficiente assorbimento (hν > Eg). Al momento, il biossido di titanio (TiO2) il catalizzatore più importante e maggiormente usato. Altri semiconduttori usati comunemente nell’ossidazione fotocatalitica sono ZnO, ZnS, CdS, Fe2O3 e SnO2. In Figura 2.3 vengono riassunti i valori di band gap per i catalizzatori più comunemente impiegati. Da questo valore, che indica l’energia che è necessario superare per far sì che si creino le coppie elettroni – lacune e che possano quindi avvenire le reazioni di ossidoriduzione, si può facilmente risalire alla lunghezza d’onda che deve avere la fonte luminosa per attivare il catalizzatore impiegato (2.1):
ë = hc (2.1) E
Dove λ è la lunghezza d’onda, h è la costante di Planck, c è la velocità della luce nel vuoto e E è l’energia del fotone.
La fotocatalisi per la rimozione dei VOC 37
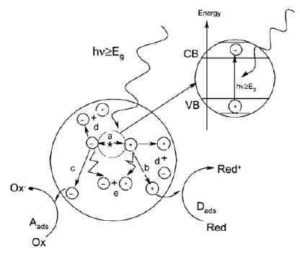 Figura 2.2 Rappresentazione schematica del processo di ossidazione fotocatalitica su di una particella di semiconduttore. (a) generazione della coppia elettrone – lacuna; (b) ossidazione della specie che dona gli elettroni (D); (c) riduzione della specie capace di accettare elettroni (A); (d) e (e) ricombinazione delle coppie elettroni – lacune sulla superficie e nel bulk della particella, rispettivamente (Carp et al., 2004).
Figura 2.2 Rappresentazione schematica del processo di ossidazione fotocatalitica su di una particella di semiconduttore. (a) generazione della coppia elettrone – lacuna; (b) ossidazione della specie che dona gli elettroni (D); (c) riduzione della specie capace di accettare elettroni (A); (d) e (e) ricombinazione delle coppie elettroni – lacune sulla superficie e nel bulk della particella, rispettivamente (Carp et al., 2004).
Figura 2.3 Posizioni delle bande di energia per i catalizzatori più comunemente utilizzati nei processi di ossidazione fotocatalitica. Sono riportati il livello più basso della banda di conduzione e il livello più alto della banda di valenza (Carp et al., 2004).
Il valore di band gap per il biossido di titanio è pari a 3.2 eV, cui corrisponde una lunghezza d’onda di 388 nm, valore che rientra nel campo delle radiazioni UV. Questi valori rappresentano rispettivamente il valore minimo di energia e il valore massimo di lunghezza d’onda che la radiazione luminosa deve avere (Wang et al., 2007)).
 Un cenno particolare va fatto sulla cinetica dei processi fotocatalitici; la cinetica deve tenere conto anche del fenomeno di adsorbimento fisico delle specie sulla superficie del catalizzatore. Per studiare le reazioni di degradazione fotocatalitica, viene generalmente impiegato il modello di Langmuir – Hinshelwood (2.2):
Un cenno particolare va fatto sulla cinetica dei processi fotocatalitici; la cinetica deve tenere conto anche del fenomeno di adsorbimento fisico delle specie sulla superficie del catalizzatore. Per studiare le reazioni di degradazione fotocatalitica, viene generalmente impiegato il modello di Langmuir – Hinshelwood (2.2):
r=−dCô = kKCô (2.2) dô 1+ KCô
Dove r è la velocità di reazione, Cτ è la concentrazione di inquinate, τ è il tempo di illuminazione, k è la costante cinetica apparente e K è la costante di equilibrio di adsorbimento. Questa formulazione, specifica per la catalisi eterogenea, tiene conto sia del fenomeno fisico dell’adsorbimento (tramite la costante K), sia del fenomeno chimico delle reazioni di ossidoriduzione (tramite la costante k).
Dal momento che le prove sperimentali realizzate in questo lavoro di ricerca utilizzano il biossido di titanio come catalizzatore e il metanolo come inquinante da rimuovere, vengono ora descritti i meccanismi della degradazione fotocatalitica su TiO2 prima, e il meccanismo specifico del metanolo poi.
Degradazione fotocatalitica su biossido di titanio
Il meccanismo di ossidazione fotocatalitica su biossido di titanio prevede innanzitutto la formazione delle coppie elettroni – lacune per effetto della radiazione luminosa. In Figura 2.4 è rappresentata schematicamente la struttura a bande di energia per il biossido di titanio.
Figura 2.4 Rappresentazione schematica della struttura a bande di energia nel biossido di titanio (Hashimoto et al., 2005).
Il meccanismo che sta alla base della fotocatalisi eterogenea è piuttosto complesso; il seguente set di reazioni (2.3-2.9), spiega quello che avviene sulla superficie del semiconduttore. Le reazioni riportate rappresentano una semplificazione di quanto accade realmente (Litter, 1999).
hí,E³E
− +
TiO →TiO (e ,h ) 2 2 cb vb
g
La fotocatalisi per la rimozione dei VOC 39
TiO (h+ )+H O →TiO +HO• +H+ 2vb 2ads 2 ads
TiO (h+ )+HO− →TiO +HO• 2 vb ads 2 ads
TiO(h+)+D →TiO+D+ 2vbads 2ads
HO•+D →TiO+D+ ads 2 ads
HO• + Dads → Doxid TiO(e−)+A →TiO+A− 2cbads 2ads
C’è tuttora oggi un dibattito aperto sul meccanismo di ossidazione; in particolare, rimane aperto il dubbio sul fatto che l’ossidazione della specie adsorbita sia da imputare all’azione dei radicali idrossilici o piuttosto all’azione diretta delle foto lacune presenti sul catalizzatore. In genere la specie A è ossigeno; si aggiungono quindi altre specie radicaliche,
le quali favoriscono ulteriormente reazioni di ossidoriduzione (Litter, 1999).
TiO (e− )+O 2cb 2,ads 2 2 2
+H+ →TiO +HO• ↔O•− +H+ HO• +TiO (e− )+H+ →H O 22cb 2
2HO• →H O +O 2222
H O +O•− →HO• +O +HO− 2222
H2O2 +hí →2HO• H O +TiO (e− )→HO• +HO− 22 2cb
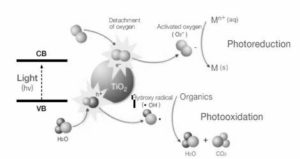
I radicali ossidrilici reagiscono con il contaminante presente nella corrente gassosa e innescano il meccanismo di ossidazione che, attraverso una serie di passaggi, porta alla completa mineralizzazione con formazione di CO2 e H2O. In Figura 2.5 riportato un disegno che riassume quanto detto circa la fotcatalisi di composti organici su biossido di titanio.
Figura 2.5
Illustrazione riassuntiva dell’ossidazione fotocatalitica di composti orgaici su TiO2.